Beyin peptidi ODN aclığı azaldır və siçovulların işində qlükoza tənzimlənməsini gücləndirir
Justin Jackson tərəfindən , Phys.org
Sadie Harley tərəfindən redaktə edilmişdir , Andrew Zinin tərəfindən nəzərdən keçirilmişdir
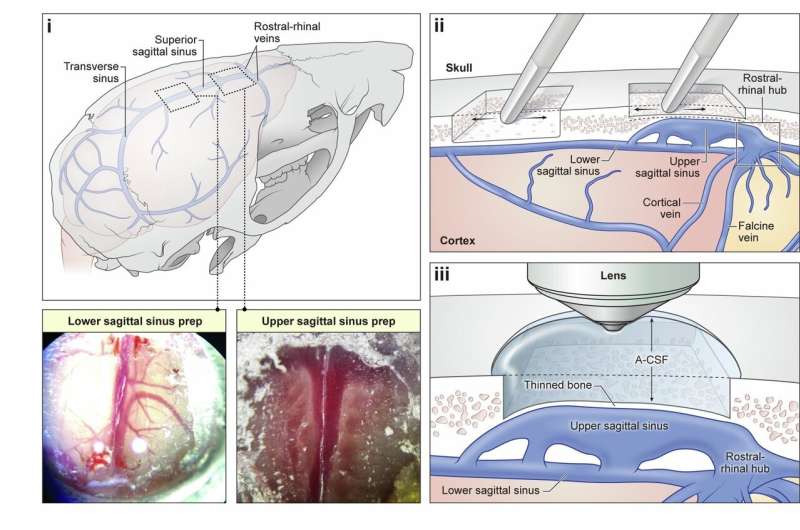
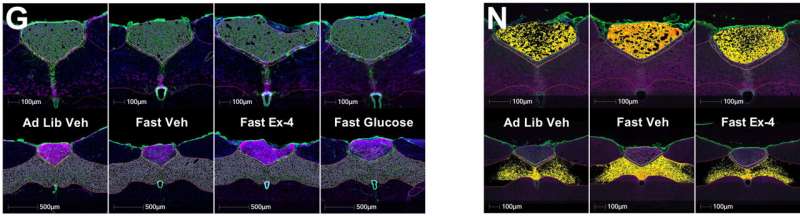
Redaktorların qeydləriNümayəndə DBI mRNA (G) və zülal (N) analiz şəkilləri. Məlumatlar ± SEM deməkdir. Hər bir təcrübə subyektlər arasında idi; [(A) – (G)] hər müalicə üçün n = 5 – 9 və hər müalicə üçün [(H) – (M)] n = 3 və ya 4. Simvollar * və ya # müvafiq olaraq mülayim və ya orta floresan intensivliyində müalicə qrupları arasında əhəmiyyəti bildirir. Floresan siqnalı HALO analiz proqramında mülayim, orta və ya güclü intensivliyə görə təbəqələşdirilmiş və universal olaraq bütün şəkillərə tətbiq edilmişdir. Məlumatlar Tukeyin post hoc [(A) – (M)] ilə ikitərəfli ANOVA ilə təhlil edilmişdir. Kredit: Caroline Geisler
Pensilvaniya Universiteti və Sirakuza Universitetinin alimləri kəşf ediblər ki, arxa beyindən əldə edilən peptid, oktadekanöropeptid (ODN) ürəkbulanma və qusmaya səbəb olmadan iştahı yatıra və qlükoza tənzimlənməsini yaxşılaşdıra bilər. Nəticələr, piylənmə və tip 2 diabetin müalicəsi üçün istifadə edilə bilən dorsal vagal kompleksdə qlia-neyron siqnal oxunu təklif edir.
Beyin sapındakı glial hüceyrələr enerji homeostazında fizioloji rolu qaranlıq qalan siqnal peptidi olan ODN istehsal edir. Tədqiqatçılar artıq arxa beyində bu peptid sisteminin birbaşa aktivləşdirilməsinin kilo itkisinə səbəb olduğunu, qlükozanın xaric edilməsini gücləndirdiyini və obez heyvanlarda insulin müqavimətini azaldır.
GLP-1 reseptorlarını hədəf alan mövcud müalicələrdən fərqli olaraq, ODN qusma ilə bağlı səlahiyyətli modellərdə ürəkbulanma ilə əlaqəli davranışları və ya qusmağı tetiklemeden bu təsirlərə nail olur.
Piylənmə və 2-ci tip diabet, yüksək yağ kütləsini və qan qlükozasını normalmış kimi saxlayan bioloji sistemlərlə xarakterizə olunur. Piylənmədə kilo itkisi aclığı artıran və enerji xərclərini azaldan əks-tənzimləyici reaksiyalara səbəb ola bilər.
2-ci tip diabetdə, qanda qlükoza artıq yüksək olsa belə, qaraciyərdən qlükoza ifrazı yüksək olaraq qalır. Bu uyğun olmayan təyinat nöqtələri korreksiyaya müqavimət göstərir və uzunmüddətli müalicəni çətinləşdirir.
Mərkəzi enerji sensoru bu sərtliyin açarıdır. Hipotalamus və dorsal vagal kompleks (DVC) kimi beyin bölgələri dövran edən və bağırsaqdan qaynaqlanan qida siqnallarında dəyişiklikləri aşkar edir.
Sağlam dövlətlərdə bu sistem enerji qəbulunda və qlükoza atılmasında çevikliyi dəstəkləyir. Piylənmə və diabetdə bu hiss pozulur. Nəticədə, normal olaraq homeostazı tənzimləyən sinir sxemləri artıqlığı saxlamaq üçün qərəzli olur.
Tədqiqatın çox hissəsi neyronlara yönəldilsə də, glial hüceyrələr , astrositlər və tanisitlər qida maddələrinin qəbulu və enerji balansında əsas oyunçular kimi ortaya çıxdı.
Astrositlər qlükoza çatışmazlığına cavab verir və xüsusilə də arxa beyində qidalanma və qlikemik tənzimləmənin qarşısını alır. Tanisitlər qlükoza, amin turşuları və lipidləri hiss edir və hormonların insulin və GLP-1 reseptor agonistləri də daxil olmaqla beyinə daxil olmasına vasitəçilik edir.
Hər iki hüceyrə növü beynin mədəciklərinə yaxın ərazilərdə diazepam bağlayan inhibitordan (DBİ) əldə edilən siqnal peptidi ODN istehsal edir. Əvvəlki iş hipotalamusda ODN ifadəsi və sərbəst buraxılmasının qlükoza və təkrar qidalanma ilə stimullaşdırıldığını göstərdi. DVC-dəki funksiyası əsasən öyrənilməmiş olaraq qalmışdır.
Science Translational Medicine jurnalında dərc olunan “Arxa beyin oktadekanuropeptid qliotransmissiyası ürəkbulanma və qusma olmadan enerji balansına nəzarət üçün terapevtik hədəf kimi” adlı araşdırmada tədqiqatçılar arxa beyindəki ODN siqnalının qidalanma, qlikemiya və glikozilliyə qarşı hormonal reaksiyaları tənzimləyib-tənzimləmədiyini qiymətləndirmək üçün bir sıra təcrübələr hazırladılar.
Təcrübələr ODN və dəyişdirilmiş analoq, tridekanöropeptiddən (TDN) istifadə edərək siçovullar, siçanlar və müşk siçanları üzərində aparılmışdır. Tədqiqatçılar daha sonra GLP-1 reseptor agonistlərinin DBI ifadəsini dəyişdirib-dəyişdirmədiyini və ODN siqnalının GLP-1 səbəb olduğu anoreksiyaya töhfə verib-vermədiyini araşdırdılar.
Tədqiqatçılar qida qəbuluna, qlükoza dözümlülüyünə, insulinə həssaslığa və hormonların sərbəst buraxılmasına təsirləri qiymətləndirmək üçün dördüncü və ya yan mədəciklərə intraserebroventrikulyar inyeksiya vasitəsilə ODN və ya TDN tətbiq etdilər.
Beyin toxuması immunofluoressensiya və in situ hibridləşmə üçün dorsal vagal kompleks subnükleilərdə DBI ifadəsini ölçmək üçün toplandı. Tək nüvəli transkriptomik məlumat dəstləri glial populyasiyalar arasında DBI transkriptlərini lokallaşdırmaq üçün istifadə edilmişdir.
ODN, çov və ya yüksək yağlı diyetlərdə saxlanılan siçovullarda qida qəbulunu dayandırdı, daha davamlı anoreksiya təsiri və diyetə səbəb olan obez heyvanlarda bədən çəkisinin azalması ilə. Yemək nümunəsinin təhlili göstərdi ki, ODN obez siçovullarda yemək ölçüsünü və müddətini azaldır, arıq siçovullarda isə təsirlər daha az nəzərə çarpır.
ODN administrasiyası arıq və obez siçovullarda insulin ifrazını artırmadan qlükoza tolerantlığını və insulinə həssaslığı yaxşılaşdırdı. ODN reseptorunun antaqonizmi qlükoza klirensini pozdu və ilkin qlikemiyanı artırdı.
5-tio-D-qlükoza və ya insulinin səbəb olduğu qlükoprivasiyaya cavab olaraq, ODN ilə əvvəlcədən müalicə kortikosterona təsir etmədən qida qəbulunu azaldıb, hiperqlikemiyanı azaldıb və dövran edən qlükaqon və sərbəst yağ turşularını aşağı salıb.
Dorsal vagal kompleksdə DBI mRNT ifadəsi qlükoza və GLP-1 reseptor agonisti eksendin-4 daxil olmaqla, təkrar qidalanma siqnalları ilə tənzimlənir, subnükleilər arasında regional fərqlər müşahidə olunur.
Antikor və ya reseptor antaqonisti tərəfindən ODN siqnalının bloklanması chow və obez siçovullarda GLP-1 reseptor agonistlərinin anoreksiya təsirini qismən zəiflətdi. Bu müdaxilələr GLP-1RA ilə induksiya edilən kaolin qəbulunu və ya qusmağı dəyişmədi, bu da ODN-nin iştahın yatırılmasına kömək etdiyini, lakin nasazlıq olmadığını göstərir.
TDN qlükoza klirensini yaxşılaşdırdı və mərkəzləşdirilmiş şəkildə tətbiq edildikdə qida qəbulunu dayandırdı. Obez siçanlarda gündəlik periferik TDN inyeksiyaları doqquz gün ərzində davamlı hipofagiya və 4,7% bədən çəkisi itkisinə səbəb oldu.
Hiperinsulinemik-euqlikemik qısqac tədqiqatları TDN ilə müalicə olunan siçanlarda qlükoza infuziya sürətinin artdığını və qaraciyərdə qlükoza istehsalının azaldığını təsdiqlədi.
Müəlliflər belə nəticəyə gəlirlər ki, dorsal vagal kompleksdə istehsal olunan ODN iştahı, qlükozanın xaric edilməsini və qlükaqonun sərbəst buraxılmasını tənzimləyən qida maddələrinin mövcudluğunun glialdan əldə edilən siqnalı kimi çıxış edir.
Mərkəzi ODN siqnalı ürəkbulanma və ya ürək-damar yan təsirləri yaratmadan qida qəbulunu və təkmilləşdirilmiş glisemik nəzarəti dayandırdı. ODN ifadəsi qlükoza və GLP-1 reseptor agonistlərinə cavab olaraq artdı və onun reseptorunu antaqonlaşdıraraq, insulin həssaslığını pozdu və GLP-1RA-dan qaynaqlanan iştahsızlığı azaldı.
Sintetik ODN törəməsinin sistemli tətbiqi, TDN, bu təsirləri obez gəmiricilərdə təqlid edərək, qida qəbulunu azaltdı və qlükoza metabolizmini yaxşılaşdırdı. Əhəmiyyətli odur ki, nə mərkəzi ODN, nə də TDN əsas bədən istiliyini, fiziki fəaliyyəti və ya ürək dərəcəsini dəyişdirməmiş, onların əlverişli təhlükəsizlik profilini vurğulamışdır.
Tədqiqatçılar, ODN-nin reseptor yolunun tez-tez piylənmə və tip 2 diabet üçün mövcud müalicələrlə əlaqəli mədə-bağırsaq dözümsüzlüyü olmadan kilo itkisi və metabolik yaxşılaşmaya nail olmaq üçün hədəf ola biləcəyini təklif edirlər .
Müəllifimiz Justin Jackson tərəfindən sizin üçün yazılmış , Sadie Harley tərəfindən redaktə edilmiş və Endryu Zinin tərəfindən yoxlanılmış və nəzərdən keçirilmiş bu məqalə diqqətli insan əməyinin nəticəsidir. Müstəqil elmi jurnalistikanı yaşatmaq üçün sizin kimi oxuculara güvənirik. Bu hesabat sizin üçün əhəmiyyət kəsb edirsə, lütfən, ianə (xüsusilə aylıq) nəzərdən keçirin. Siz təşəkkür olaraq reklamsız hesab əldə edəcəksiniz .
Daha çox məlumat: Caroline E. Geisler et al, Hindbrain oktadecaneuropeptide gliotransmission, ürəkbulanma və qusma olmadan enerji balansına nəzarət üçün terapevtik hədəf kimi, Elm Tərcümə Tibb (2025). DOI: 10.1126/scitranslmed.adu6764
Jurnal məlumatı: Science Translational Medicine
© 2025 Science X Network