Canlı hüceyrə izləmə, zülal qatlanma köməkçiləri ilə yeni istehsal olunan zülallar arasında dinamik qarşılıqlı təsiri ortaya qoyur
Christiane Menzfeld, Max Planck Cəmiyyəti tərəfindən
Lisa Lock tərəfindən redaktə edilib , Robert Egan tərəfindən nəzərdən keçirilib
Tercih edilən mənbə kimi əlavə edin
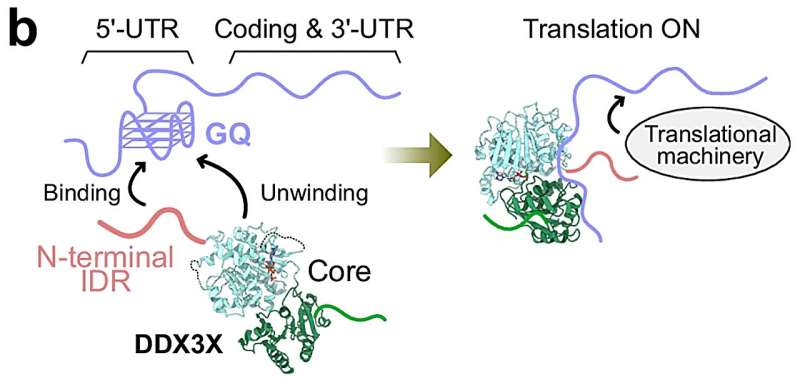
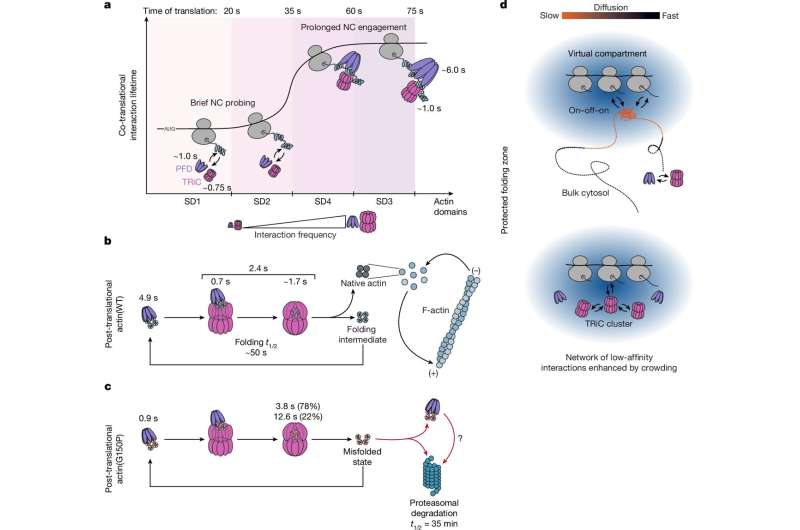
TRiC-PFD vasitəçiliyi ilə in vivo zülal qatlanmasının dinamikası. Müəllif: Nature (2026). DOI: 10.1038/s41586-025-10073-3
Zülallar hüceyrələrin molekulyar maşınlarıdır. Onlar ribosom adlanan protein fabriklərində, öz planlarına – genetik məlumatlara əsasən istehsal olunurlar. Burada zülalların əsas tikinti blokları olan amin turşuları uzun protein zəncirlərinə yığılır. Maşının tikinti blokları kimi, fərdi zülalların da funksiyalarını düzgün yerinə yetirməsi üçün müəyyən üçölçülü quruluşa malik olması lazımdır.
Buna nail olmaq üçün insan hüceyrələrində yeni istehsal olunan zülal zəncirləri, TRiC/PFD və ya HSP70/40 kimi şaperonlar kimi tanınan müxtəlif zülal qatlama köməkçi zülallarının köməyi ilə sabit və funksional formasına qatlanır. Zülal qatlama köməkçiləri, amin turşusundan asılı olaraq fərqli kimyəvi xüsusiyyətlərə malik olan amin turşusu zəncirlərini hüceyrə mühitindən təcrid edir. Bu, yeni istehsal olunan zülal zəncirlərinin bir-birinə yapışıb xəstəliyə səbəb olmasının qarşısını alır.
Maks Plank Biokimya İnstitutunun direktoru F.-Ulrich Hartl onilliklər ərzində zülal qatlanması mexanizmlərini öyrənib. Hartlın şöbəsinin alimi və Nature jurnalında dərc olunmuş yeni bir tədqiqatın iki aparıcı müəllifindən biri olan Niko Dalheimer izah edir: “Zülal qatlanması haqqında bildiklərimizin çoxu sınaq borularında aparılan tədqiqatlardan öyrənilib. Lakin, hüceyrə mühitini in vitro şəraitində dəqiq şəkildə təkrarlamaq faktiki olaraq mümkün deyil.”
“Test borusundan fərqli olaraq, hüceyrə zülallar, nuklein turşuları və lipidlər kimi bir çox müxtəlif makromolekullarla dolu olduqca mürəkkəb bir mühitdir. Şaperonların necə işlədiyini tam başa düşmək üçün, canlı hüceyrələrin flüoresan etiketləməsindəki irəliləyişlər sayəsində yalnız bu yaxınlarda mümkün olan bir yanaşma olan flüoresan mikroskopda tək hissəcik izləmə üsulundan istifadə edərək TRiC və PFD-nin təbii mühitində – bütöv insan hüceyrələrində – zülal qatlanma dinamikasını araşdırdıq.”
TRiC və prefoldin
Yeni sintez olunmuş zülal ribosomlar tərəfindən bir kanal vasitəsilə tədricən amin turşusu zənciri kimi sərbəst buraxılır. Yeni sintez olunmuş zülalın bir-birinə yapışmasının qarşısını almaq üçün sərbəst amin turşusu qalıqları prefoldin və ya qısaca PFD, TRiC-nin koşaperonu tərəfindən tutulur və qorunur. Daha sonra koşaperon zülalı qatlanmaq üçün şaperonin TRiC-yə ötürür.
TRiC, barel formalı zülal qatlanma köməkçisidir və bakteriya GroEL/ES ilə əlaqəlidir. Tədqiqatın həmmüəllifi və alim Rongqin Li bildirir ki, ” TRiC hüceyrədəki zülalların yalnız 10%-nin qatlanmasına kömək etsə də, onların bir çoxu, o cümlədən sitoskeletonun tikinti blokları olan aktin və tubulin hüceyrə üçün xüsusilə vacibdir. Buna görə də zülal qatlanmasının bu hissəsinə baxdıq. Hüceyrələrdə qatlanma dinamikasını anlamaq üçün aktini sınaq zülalı kimi istifadə etdik.”
Tək hissəcik izləmə naməlum şeylərə işıq salır
Zülal qatlanmasında iştirak edən bütün komponentlərin real vaxt qarşılıqlı təsirini izləmək üçün tədqiqatçılar TRiC və prefoldini, eləcə də aktin yeni yaranan zəncirini birbaşa şaperon substratı, ribosomları və mRNT-ləri isə müxtəlif şəraitlərdə iki rəngli, yaşıl və magenta olan şaperon substratları üçün proksilər kimi qeyd etdilər. Əgər iki komponent bir-birinə yaxın, yəni 500 nanometrdən az məsafədə olarsa, rənglər üst-üstə düşür və mikroskop altında ağ nöqtələr kimi görünürdü.
Dalheimer izah edir: “Tək bir hüceyrədə təxminən 10 milyon ribosom var . Mikroskop altında fərdi ribosomları və digər komponentləri izləməyimiz üçün ribosomların hamısını deyil, yalnız kiçik bir hissəsini rənglədik və fərdi molekulları və onların şaperonlarla qarşılıqlı təsirini izləmək üçün TIRF metodundan istifadə etdik. Bu, dərin bir dənizi araşdıran dalğıc kimidir: dalğıc bir anda yalnız bir neçə nöqtəyə işıq salmaqla ətrafındakı gizli dinamik həyat və fəaliyyətə nəzər sala bilər.”
Gündəlik məlumat üçün Phys.org-a etibar edən 100.000-dən çox abunəçi ilə elm, texnologiya və kosmosdakı ən son yenilikləri kəşf edin . Pulsuz bülletenimizə abunə olun və vacib olan nailiyyətlər, innovasiyalar və tədqiqatlar haqqında gündəlik və ya həftəlik yeniliklərdən xəbərdar olun .
‘Görmək inanmaqdır’
Alimlər müşahidə ediblər ki, TRiC və PFD ribosomdan çıxan yeni sintez olunmuş aktin zülal zənciri ilə təxminən bir saniyə ərzində dəfələrlə zondlayır. PFD, aktin ribosomdan ayrılmazdan qısa müddət əvvəl yaranan zənciri saxlayır və qatlanmanın tamamlanması üçün onu TRiC şaperonuna təhvil verir.
Li əlavə edir: “Maraqlıdır ki, TRiC və aktin mutantları, yəni düzgün qatlanmasını pozmaq üçün səhvlər daxil etdiyimiz zülal zəncirləri arasındakı əlaqə xeyli uzun idi. Normal vəziyyətdən fərqli olaraq, qatlanma qüsurlu aktin şaperonin sistemi tərəfindən bir neçə dəfə qatlanma cəhdinə məruz qalır və nəticədə parçalanmaya hədəf olur.”
F.-Ulrich Hartl xülasə edir: “Onilliklərdir ki, biz və başqaları şaperon vasitəçiliyi ilə zülal qatlanmasını əsasən biokimyəvi təcrübələr vasitəsilə öyrənmişik ki, bu da bu prosesin necə idarə olunduğunu müəyyən etmək üçün vacib olmuşdur. Canlı hüceyrə tək hissəcik izləmə ilə indi bu anlayışları birbaşa canlı hüceyrələrdə araşdıra bilərik. Bunu etməklə, klassik biokimyəvi təcrübələrdən əsas tapıntıları təsdiqlədik, eyni zamanda ansambl əsaslı analizlərlə aşkar edilə bilməyən qorunan qatlanma zonası kimi xüsusiyyətləri aşkar etdik.”
“Bu proseslərin canlı hüceyrələrdə tək molekul səviyyəsində vizuallaşdırılması ilk dəfədir. Həmkarlarıma tez-tez dediyim kimi, ‘görmək inanmaqdır’.”
Nəşr detalları
Rongqin Li və digərləri, TRiC şaperonin sisteminin in vivo tək molekullu dinamikası, Nature (2026). DOI: 10.1038/s41586-025-10073-3
Jurnal məlumatı: Təbiət
Əsas anlayışlar
Biomolekulyar və subhüceyrəvi proseslərHüceyrə quruluşu, fiziologiyası və dinamikasıKonformasiya və topologiyaTək molekullu texnikalar
Maks Plank Cəmiyyəti tərəfindən təmin edilir