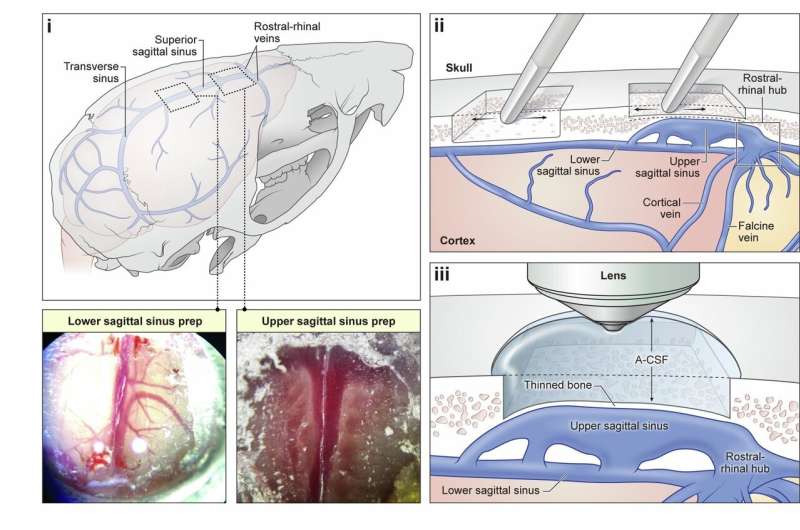
Həm CAR, həm də TCR-ləri ifadə edən mühəndis T-hüceyrələri xərçəngli və sağlam toxumaları daha yaxşı ayırd edə bilər.

Tədqiqatçılar daha təhlükəsiz və daha effektiv xərçəng müalicəsi vəd edən yenilikçi ikili reseptorlu T-hüceyrə terapiyası hazırlayıblar. Cell -də nəşr olunan bu araşdırma göstərir ki, həm Ximerik Antigen Reseptorunu (CAR) həm də T-hüceyrə Reseptorunu (TCR) ifadə etmək üçün T-hüceyrələrinin mühəndisliyi onların xərçəngli və sağlam toxumaları ayırd etmək qabiliyyətini təkmilləşdirə bilər və bu, cari immunoterapiyada əsas problemi həll edir.
Xərçənglə mübarizə üçün bədənin immun sisteminin istifadəsini əhatə edən müalicələr, xüsusilə də CAR T-hüceyrə terapiyası adlı metoddan istifadə etməklə, son illərdə xəstələrin sağ qalmasında əhəmiyyətli irəliləyişlərə səbəb olmuşdur. Bu müalicə xəstənin öz T-hüceyrələrinin çıxarılmasını və bir şiş zülalını tanıyan Ximerik antigen reseptoru (CAR) adlı xüsusi reseptoru ifadə etmək üçün onların laboratoriyada dəyişdirilməsini əhatə edir . Bunlar daha sonra xərçəng hüceyrələrini tapıb məhv edə biləcəkləri xəstəyə təkrar yeridilir .
Bununla belə, CAR T-hüceyrələri qan xərçənglərinin müalicəsi üçün böyük vədlər versələr də, bərk şişləri effektiv şəkildə hədəf almaq üçün mübarizə apardılar. CAR-lar şiş hüceyrələrini eyni hədəf zülalı olan sağlam hüceyrələrdən asanlıqla ayırd edə bilmirlər ki, bu da bərk şişlərin müalicəsi zamanı əsas problemdir , çünki bərk xərçəngi əhatə edən sağlam toxuma çox vaxt sağ qalmaq üçün kritikdir, lakin şişlərin özlərinə oxşar zülalları ifadə edir.
Bunun əksinə olaraq, T-hüceyrə reseptorları (TCR) olan təbii T-hüceyrələri şiş hüceyrələri ilə sağlam hüceyrələr arasında daha yaxşı fərqlənir. Bununla belə, TCR əsaslı müalicələr çox vaxt şişlərə qarşı məhdud effektivlikdən əziyyət çəkir.
Oksford Universitetinin Kennedi Revmatologiya İnstitutunun tədqiqatçıları, Milli Xərçəng İnstitutu (NCI) və Montreal Universiteti ilə əməkdaşlıq edərək, bu məhdudiyyətləri aradan qaldırmaq üçün bu yanaşmaları birləşdirməyə başladılar.
https://googleads.g.doubleclick.net/pagead/ads?gdpr=0&us_privacy=1—&gpp_sid=-1&client=ca-pub-0536483524803400&output=html&h=280&slotname=8188791252&adk=1645945215&adf=4054963813&pi=t.ma~as.8188791252&w=750&abgtt=6&fwrn=4&fwrnh=0&lmt=1747048051&rafmt=1&armr=3&format=750×280&url=https%3A%2F%2Fphys.org%2Fnews%2F2025-05-cells-cars-tcrs-distinguish-cancerous.html&fwr=0&rpe=1&resp_fmts=3&wgl=1&uach=WyJXaW5kb3dzIiwiMTkuMC4wIiwieDg2IiwiIiwiMTM2LjAuNzEwMy45MyIsbnVsbCwwLG51bGwsIjY0IixbWyJDaHJvbWl1bSIsIjEzNi4wLjcxMDMuOTMiXSxbIkdvb2dsZSBDaHJvbWUiLCIxMzYuMC43MTAzLjkzIl0sWyJOb3QuQS9CcmFuZCIsIjk5LjAuMC4wIl1dLDBd&dt=1747048025914&bpp=1&bdt=72&idt=34&shv=r20250507&mjsv=m202505060101&ptt=9&saldr=aa&abxe=1&cookie=ID%3Df22668bce9793ae4%3AT%3D1735196613%3ART%3D1747047932%3AS%3DALNI_Mb4Xpwl1SO1AcvqroR6xccDm_sheQ&gpic=UID%3D00000f7c5320f40b%3AT%3D1735196613%3ART%3D1747047932%3AS%3DALNI_Mb1dz_DHiT2yDzXLMaB9CDkQl4XGg&eo_id_str=ID%3Dcdf7f2f01784f52d%3AT%3D1735196613%3ART%3D1747047932%3AS%3DAA-Afjb8kbeupLLyQ0QHQmZxpM4v&prev_fmts=0x0%2C1905x945&nras=2&correlator=5245772768295&frm=20&pv=1&rplot=4&u_tz=240&u_his=5&u_h=1080&u_w=1920&u_ah=1032&u_aw=1920&u_cd=24&u_sd=1&dmc=8&adx=448&ady=2065&biw=1905&bih=945&scr_x=0&scr_y=177&eid=31092193%2C31092196%2C95333411&oid=2&pvsid=2404371100190675&tmod=1568226261&uas=1&nvt=1&ref=https%3A%2F%2Fphys.org%2F&fc=1920&brdim=0%2C0%2C0%2C0%2C1920%2C0%2C1920%2C1032%2C1920%2C945&vis=1&rsz=%7C%7CpeEbr%7C&abl=CS&pfx=0&fu=128&bc=31&bz=1&td=1&tdf=2&psd=W251bGwsbnVsbCxudWxsLDNd&nt=1&ifi=2&uci=a!2&btvi=1&fsb=1&dtd=25231
Kennedi İnstitutunun NIH/Oxford aspirantı Sooraj Achar və NCI-də doktoranturadan sonrakı tədqiqatçı Dr. Taisuke Kondo həm TCR, həm də CAR ifadə edən hüceyrələr yaratmaq üçün birlikdə çalışdılar. Onlar həm yüksək məhsuldarlığa malik IMMUNOtron robot platformasından, həm də heyvan modellərindən istifadə edərək yüzlərlə liqand birləşməsinə cavablarını xarakterizə etdilər. Təəccüblüdür ki, topladıqları məlumatlar zəif TCR siqnallarının CAR fəaliyyətini maneə törətdiyini göstərir.
Montreal Universitetinin aspirantı Fransua Bourassa bu gözlənilməz hadisəni izah etmək üçün paylaşılan inhibitor siqnal molekullarının vasitəçiliyi ilə reseptorlararası çarpaz əlaqənin riyazi modelini işləyib hazırlayıb. Kennedi İnstitutunda yüksək rezolyusiyaya malik mikroskopiyadan istifadə etməklə aparılan sonrakı təcrübələr birgə stimullaşdırma zamanı iki növ reseptor arasında yaxınlığı təsdiqlədi və bu modeli təsdiq etməyə kömək etdi.
Tədqiqatçılar daha sonra bu fikirləri birləşdirərək, Antaqonizmlə Təhlükəli Əyləc Sistemi (AEBS) CAR T hüceyrəsi adlı yeni CAR T sistemini inkişaf etdirdilər. O, bu mühüm hüceyrələrə qarşı arzuolunmaz CAR T-hüceyrə fəaliyyətini “tormozlamaq” üçün sağlam toxumalardakı zülallar tərəfindən zəif stimullaşdırılan (və buna görə də inhibə olunan) CAR-T hüceyrələrinə TCR əlavə etməklə işləyir. Eyni TCR xərçəng hüceyrələrində bu zülalların mutasiyaya uğramış versiyalarını tanıdıqda, güclü şəkildə cavab verir və şişlərə qarşı CAR T hüceyrələrinin fəaliyyətini “sürətləndirir”.
Bu yanaşma AEBS CAR T hüceyrələrinin şişlərə qarşı effektivliyini artırarkən sağlam hüceyrələrə qarşı daha az aqressiv olmağa imkan verir.
NCI-nin İnteqrativ Xərçəng İmmunologiyası Laboratoriyasının rəis müavini Dr. Gregoire Altan-Bonnet, “Bu mühəndis T-hüceyrələrinin xərçəngli və sağlam hüceyrələri ayırd etmək qabiliyyətini yaxşılaşdırmaqla, tədqiqatımız immunoterapiyada daha yaxşı nəticələrə yol açır” dedi.
Kennedi İnstitutunun Molekulyar İmmunologiya üzrə professoru, professor Maykl Dastin əlavə etdi: “Kennedi İnstitutunda gələcək iş AEBS CAR T hüceyrələrinin immunoloji sinapslarının təhlili vasitəsilə reseptorlar arasında qarşılıqlı əlaqənin miqdarını artırmağa yönəldiləcək, potensial olaraq xərçəng illərində immunoterapiyanın daha təhlükəsiz və effektiv formalarının yaranmasına imkan verəcək.”
Daha çox məlumat: Taisuke Kondo et al, CAR T hüceyrələrinə mühəndislik TCR ilə idarə olunan qeyri-səlis məntiq terapevtik spesifikliyi artırır, Cell (2025). DOI: 10.1016/j.cell.2025.03.017
Jurnal məlumatı: Cell
NDORMS, Oksford Universiteti tərəfindən təmin edilmişdir