Mitoxondrial fermentin atom səviyyəli quruluşu onun RNT-ni necə emal etdiyini göstərir
Linda Lindell, Karolinska İnstitutu
Lisa Lock tərəfindən redaktə edilmiş , Robert Eqan tərəfindən nəzərdən keçirilmişdir
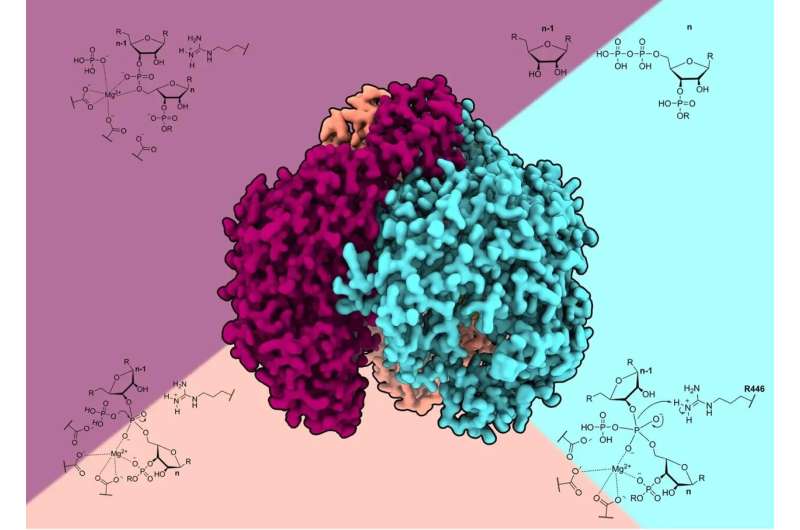
Redaktorların qeydləriReaksiya mexanizminin sxemi ilə yanaşı insan PNPase-nin krio-elektron rekonstruksiyası. Kredit: Ole Unseld
Karolinska İnstitutunun Hüceyrə və Molekulyar Biologiya Departamentinin tədqiqatçıları insan polinükleotid fosforilazının (hPNPase) ilk təfərrüatlı molekulyar şəkillərini çəkərək, bu əsas mitoxondrial fermentin zərif baza çevirmə mexanizmi vasitəsilə RNT-ni necə parçaladığını ortaya qoydular.
Nuklein Turşuları Tədqiqatında dərc edilən tapıntılar , fermentin katalitik dövrünün atom səviyyəsində misli görünməmiş təfərrüatlarını təqdim edir və bu zülaldakı mutasiyaların necə ağır irsi xəstəliklərə səbəb olduğunu izah edir.
İki mərhələli molekulyar xoreoqrafiya
Tədqiqat qrupu tək hissəcikli krio-elektron mikroskopiyasından istifadə edərək hPNPase-ni üç fərqli funksional vəziyyətdə qeydə aldı və mahiyyət etibarilə atoma yaxın qətnamədə RNT-nin parçalanmasının molekulyar filmini yaratdı. Strukturlar göstərir ki, ferment dəqiq RNT emalını təmin etmək üçün mürəkkəb iki mərhələli mexanizmdən istifadə edir.
İlk müəllif Ole Unseld, Ph.D., “Fermentin RNT-ni harada və nə vaxt kəsdiyini idarə etmək üçün terminal nukleotidləri 180 dərəcə fırladan əsas hərəkətdən istifadə etdiyini kəşf etdikdə təəccübləndik” deyir. tələbə, Hüceyrə və Molekulyar Biologiya şöbəsinin elmi işçisi, KI.
“İlkin yükləmə vəziyyətində, RNT, RNT-ni düzgün tanıyan və vaxtından əvvəl parçalanmanın qarşısını alan U formalı bir konformasiya qəbul edir. Yalnız terminal əsasları çevrildikdən sonra kəsikli fosfat rabitəsi kataliz üçün mövqeyə keçir.”
Strukturlar göstərir ki, maqnezium ionu əvvəlcə hücum edən fosfat molekulunu yerləşdirir, sonra isə reaksiya keçid vəziyyətini sabitləşdirir. Bu mexaniki təfərrüat səviyyəsi indiyədək heç bir eukaryotik polinükleotid fosforilaz üçün əldə edilməmişdir.
Keçici vəziyyətlərin tutulması
Katalitik dövrün müxtəlif mərhələlərini tutmaq üçün tədqiqatçılar strateji biokimyəvi yanaşmalardan istifadə ediblər. Yükləmə vəziyyəti üçün onlar fosforotioat modifikasiyaları olan RNT substratlarından istifadə etdilər ki, bu da parçalanmağı yavaşlatır, lakin onu ləğv etmir. Katalitikdən əvvəlki vəziyyət üçün onlar fosfatı aktiv yerdə bağlanan, lakin katalizi dəstəkləyə bilməyən sulfatla əvəz etdilər.
İkinci müəllif Hrishikesh Das, eyni şöbənin tədqiqat mütəxəssisi, “Bu layihə reaksiyanın aralıq vəziyyətlərini diqqətlə sabitləşdirməyi tələb etdi ki, biz orta deyil, diskret addımları görə bilək”. “Krio-EM-in biokimya ilə inteqrasiyası Mg²⁺-ion və Pi rollarını təyin etmək və RNT-nin bağlanması və kataliz zamanı konformasiya dəyişikliklərinin ardıcıllığını təsvir etmək üçün əsas idi.”
RNT kütlə spektrometriyası təcrübələri biokimyəvi və struktur işi tamamladı, hPNPase-nin əsasən RNT 3′ ucundan dinukleotid məhsullarını buraxdığını, trinukleotidlərin minimal məhsul uzunluğunu təmsil etdiyini aşkar etdi. Bu emal nümunəsi bakterial fermentlərdən fərqlənir və insan fermentinin aktiv sahəsinin struktur məhdudiyyətlərini əks etdirir.
RNT girişinin gözlənilməz yolu
Tədqiqat RNT-nin fermentin aktiv sahəsinə necə daxil olduğuna dair uzun müddətdir mövcud olan fərziyyəni alt-üst etdi. RNT-nin mərkəzi məsamədən keçdiyi bakterial PNPazalardan fərqli olaraq, insan fermentinin məsaməsi çevik zülal döngələri ilə bağlanır. Bunun əvəzinə strukturlar göstərir ki, tək zəncirli RNT trimerik birləşməyə onun altından daxil olur.
Tədqiqata rəhbərlik edən KI, Hüceyrə və Molekulyar Biologiya Departamentinin əsas tədqiqatçısı Martin Hällberg, “Bu tamamilə gözlənilməz oldu” dedi. “Məsamələri bağlayan çevik ilmələr sadəcə RNT-nin daxil olmasını maneə törətmir, onlar RNT bağlandıqda aktiv sahəni sabitləşdirərək fermentin fəaliyyətini aktiv şəkildə tənzimləyirlər. Bu, daha sadə orqanizmlərdə görünməyən eukaryotik uyğunlaşmanı təmsil edir.”
Komandanın biokimyəvi təcrübələri, fermentin fəaliyyət üçün həm fosfat, həm də maqnezium ionlarına ehtiyac duyduğunu və sulfatın kimyəvi reaksiyaya dəstək vermədən fosfat bağlayan yeri tutaraq katalizi bloklaya biləcəyini nümayiş etdirərək struktur tapıntılarını təsdiqlədi.
Gündəlik anlayışlar üçün Phys.org-a etibar edən 100.000-dən çox abunəçi ilə elm, texnologiya və kosmosda ən son yenilikləri kəşf edin . Pulsuz xəbər bülleteni üçün qeydiyyatdan keçin və mühüm nailiyyətlər, yeniliklər və tədqiqatlar haqqında gündəlik və ya həftəlik yeniləmələr əldə edin .
Bakterial fermentlərdən struktur fərqlər
Bakterial polinükleotid fosforilazlarla ətraflı müqayisə insan fermentində əsas struktur uyğunlaşmaları aşkar etdi. Aktiv sahə prokaryotlarda olmayan bir amin turşusu əlavəsini ehtiva edir və alfa-spiral domen RNT substratına daha yaxın yerdə yerləşdirilir. Bu dəyişikliklər əlavə protein-RNT kontaktları ilə sabitləşən əyilmiş RNT konformasiyası yaradır.
Bu struktur fərqləri insan PNPase-nin bir neçə unikal xüsusiyyətini izah edir: 8-oksoguanozin tərkibli oksidləşdirici şəkildə zədələnmiş RNT-ni səmərəli şəkildə emal etmək qabiliyyəti, mononukleotid məhsulları əvəzinə oliqonukleotid istehsalı və bakterial versiyalarla müqayisədə azalmış poliadenilləşmə aktivliyi. Uyğunlaşmalar, ehtimal ki, mitoxondriyanın oksidləşdirici mühitini və ökaryotik hüceyrələrin ixtisaslaşmış keyfiyyətə nəzarət tələblərini əks etdirir.
Niyə vacibdir
Bu tədqiqat əsas ferment mexanizmlərinə diqqət yetirsə də, tapıntılar insan xəstəliklərini anlamaq üçün birbaşa əhəmiyyət kəsb edir. hPNPase-ni kodlayan PNPT1 genindəki mutasiyalar Leigh sindromuna (ağır, mütərəqqi nevroloji pozğunluq), irsi eşitmə itkisinə və tənəffüs zəncirinin çatışmazlığına səbəb olur. Bu şərtlər hPNPase-nin mitoxondrial RNT keyfiyyətinə nəzarəti saxlamaq üçün vacib olduğu üçün yaranır. Ferment nasaz olduqda, aberrant RNT molekulları toplanır və hüceyrənin enerji istehsalını pozur.
Tədqiqat genetik məsləhət üçün molekulyar çərçivə təmin edir. Bu tədqiqatda müəyyən edilmiş aktiv sahə qalıqlarına təsir edən mutasiyaların, məsələn, maqneziumu əlaqələndirən aspartatlar və ya RNT bağlayan argininlər, xüsusilə patogen ola bilər. Əksinə, funksional yerlərdən uzaq olan səth bölgələrindəki mutasiyalar xoşxassəli variantlar ola bilər. Bu struktur-funksiya xəritəsi təsirlənmiş ailələr üçün genetik test nəticələrinin şərhini yaxşılaşdırır.
Hällberg deyir: “Bu fermentin atom səviyyəsində necə işlədiyini dəqiq başa düşmək bizə mutasiyaların niyə xəstəliklərə səbəb olduğu ilə bağlı mühüm fikirlər verir”. “Strukturlar RNT-nin bağlanması, kataliz edilməsi və tənzimlənməsi üçün hansı amin turşularının kritik olduğunu dəqiq göstərir. Klinisyenler xəstələrdə yeni PNPT1 mutasiyalarını müəyyən etdikdə, indi bu dəyişikliklərin ferment funksiyasını pozub-dağıtmayacağını təxmin etmək üçün struktur modellərimizlə əlaqələndirə bilərlər.”
Gələcək istiqamətlər
Tədqiqat bir neçə yeni araşdırma yolları açır. Komanda indi hPNPase-nin mitoxondrial helikaz hSuv3 ilə necə qarşılıqlı əlaqədə olduğunu, deqradosom adlanan daha böyük RNT deqradasiya kompleksi yaratmaq üçün öyrənir. Bu işdə müəyyən edilmiş çevik tənzimləyici döngələr, inkişaf etmiş tənzimləyici şəbəkəni təklif edən tərəfdaş zülalları üçün bağlama yerləri təmin edə bilər.
Terapevtik tətbiqlər uzaqda qalsa da, struktur məlumatlar gələcək dərman kəşfi səyləri üçün zəmin yaradır. Aktiv sahənin arxitekturası və əsas katalitik qalıqların identifikasiyası son nəticədə ferment fəaliyyətini modulyasiya edən kiçik molekulların inkişafına imkan verə bilər. Bununla belə, bu cür tətbiqlər illərdir və geniş əlavə araşdırma tələb edəcəkdir.
Daha çox məlumat: Ole Unseld və digərləri, İnsan mitokondrial PNPase tərəfindən Döngə vasitəçiliyi ilə tənzimləmə və əsas sürüşmə sürücüsü RNT parçalanması, Nuklein Turşuları Araşdırması (2025). DOI: 10.1093/nar/gkaf1296
Jurnal məlumatı: Nuklein turşularının tədqiqatı
Karolinska İnstitutu tərəfindən təmin edilmişdir