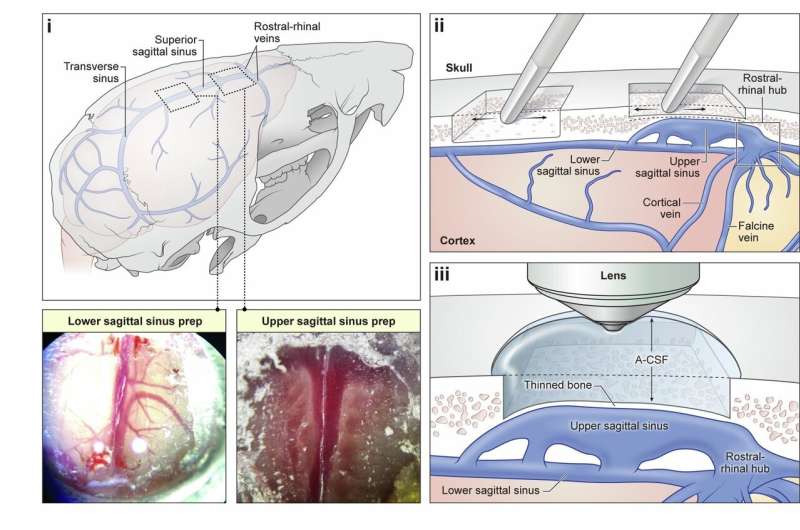
Qırmızı işıq, yaşıl işıq: titrəyən flüoroforlar hüceyrələrdə biokimyanı aşkar edir

Pandemiya tərəfi layihəsində sirli parıltı canlı hüceyrələrdə qarşılıqlı təsir göstərən zülalları müşahidə etmək üçün yeni üsula gətirib çıxarır.
Canlı hüceyrələr zülallarla doludur. Lakin bu zülallar nadir hallarda tək işləyirlər; keçici və ya uzunmüddətli komplekslər yaratmaq üçün digər zülallarla cütləşərək hüceyrə davranışını idarə edirlər. Kaliforniya Universitetinin biofiziki, Berkli (UC Berkeley) Tomas Qrem deyir: “Hüceyrədəki zülalların çoxu monoqam deyil, belə deyək.
Bu əlaqələr funksiyaya təsir göstərir: zülal hansı molekullarla qarşılıqlı əlaqədə olmasından asılı olaraq bir neçə hüceyrə funksiyasını yerinə yetirə bilər.
Lakin hüceyrələrdə zülal komplekslərinin öyrənilməsi çətin olmuşdur. Əksər üsullar bir sınaq borusunda öyrənmək üçün zülal əldə etmək üçün hüceyrələrin sındırılmasını və ya molekulların etiketlənməsini tələb edir – lakin tez-tez etiketlər qarşılıqlı təsirləri etibarlı şəkildə müşahidə etmək üçün çox seyrək paylanır. 2022-ci ildə Graham və onun biokimyaçı Robert Tjian və biofizik Xavier Darzacq laboratoriyasındakı həmkarları UC Berkeley-dəki canlı hüceyrələrdə bu qarşılıqlı təsirləri 1 -ci molekul səviyyəsində tutmağın bir yolunu təsvir etdilər . Proximity-assisted photoactivation (PAPA) adlanan üsul, qaranlıq vəziyyətdən yaxınlıqdakı ikinci flüoroforu yenidən aktivləşdirmək üçün bir flüoroforun yaşıl işıqla həyəcanlanmasından istifadə edir. İşıqlanan zülalların əksəriyyəti yaxınlıqdadır və buna görə də həyəcanlanmış flüoroforu daşıyan zülalla eyni kompleksdə olma ehtimalı yüksəkdir. “PAPA, ilk dəfə olaraq, bizə müəyyən bir tərəfdaşla qarşılıqlı əlaqədə olan molekulları işıqlandırmağa və hüceyrə daxilində bu cüt qarşılıqlı təsirlərə baxmağa imkan verir” dedi Graham.
Yeni və təkmilləşdirilmiş
İyunun 25-də dərc edilmiş bir preprintdə komanda, gen transkripsiyasının 2 tənzimlənməsində əsas addımın molekulyar dinamikasını müəyyən etmək üçün onu sürətli tək molekullu izləmə (fSMT) ilə birləşdirərək texnika üzərində qurur . Onlar yeni metodu PAPA-fSMT adlandırırlar.
Əvvəlki iş “konseptin çox gözəl sübutu idi, lakin burada onlar tək molekullu izləmə əlavə edərək, zülal kompleksinin, eləcə də fərdi zülalın diffuziyasını həqiqətən ölçə bilsinlər” deyə, Sua Myong deyir. Boston, Massaçusetsdəki Harvard Tibb Məktəbinin biofiziki, tədqiqatda iştirak etməmişdir. “Bu kinetikanı ilk dəfə canlı hüceyrələrdə göstərirlər.”
Graham, PAPA-nın COVID-19 kilidlənməsi zamanı təsadüfən aşkar edildiyini söylədi. Nüvədəki ribosomların yığıldığı bir quruluş olan nüvənin tədqiqinin bir hissəsi olaraq, Graham həyəcan verici qırmızı flüoresan boya ilə yaşıl rəng arasında keçmək üçün müəyyən dalğa uzunluqlarından istifadə edirdi. Gözlənildiyi kimi, qırmızı molekullar fotoağartma nəticəsində tez yox oldu, bu da molekulyar quruluşunu elə dəyişdi ki, flüoresan ola bilmədi. Lakin o, dalğa uzunluqlarını dəyişməyə davam etdikcə, qırmızı boya yenidən peyda oldu – hissəciklərin bəziləri fotoağartılmadan qaranlıq vəziyyətə düşdü və yaşıl işığın həyəcanlanması ilə dolayı yolla yenidən aktivləşdi (bax “Məlumatlı qarşılıqlı əlaqə”). Əlavə tədqiqatlar göstərdi ki, yenidən aktivləşmək üçün qırmızı işarəli zülal yaşıl işarəli zülala yaxın olmalıdır ki, bu da iki zülalın eyni kompleksdə birləşdiyini göstərir. “Bu, çox gözlənilməz idi” dedi Graham. “Mən əvvəllər heç vaxt belə bir şey görməmişdim.”
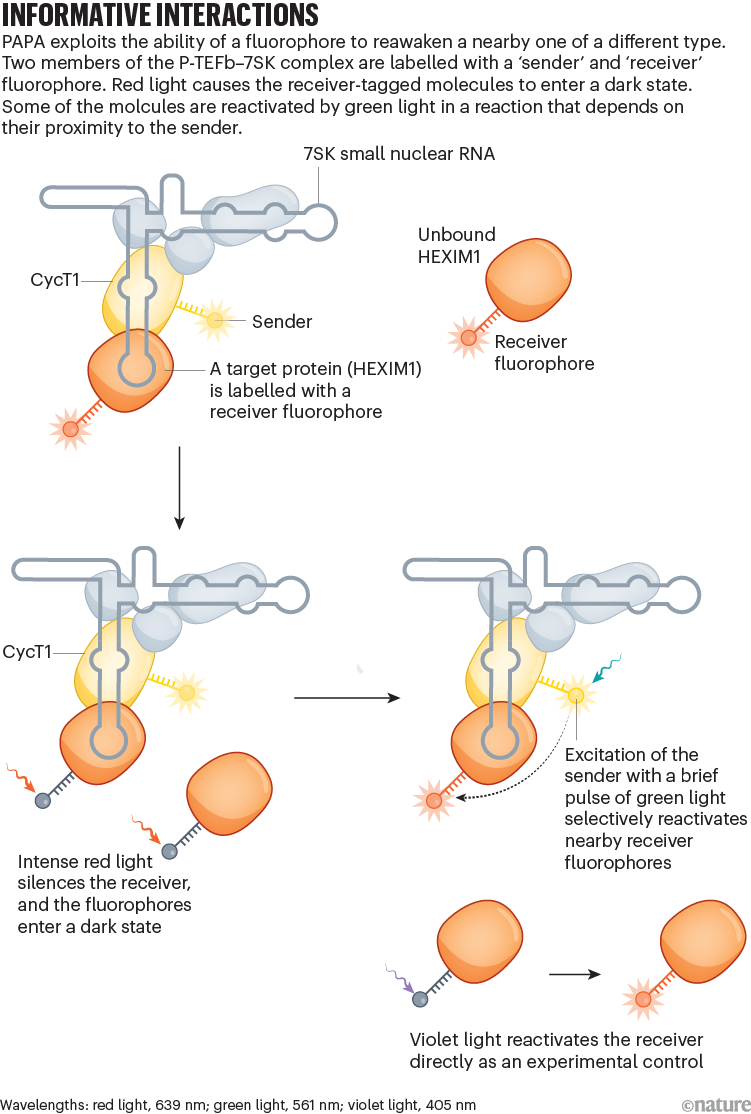
Molekullar bir-birindən cəmi 68 ångströms və ya DNT ikiqat spiralının diametrindən demək olar ki, 3,5 dəfə çox yaxın məsafədə olduqda yenidən aktivləşmə siqnalı ən güclü idi, lakin bu məsafədən 2,5 dəfə çox aşkar edilə bildi.
Qrem uyğun boyaların tam çeşidini hələ xarakterizə etməsə də, o, təsiri rodamin və karborhodamin boyaları, eləcə də bəzi flüoresan zülallarla görmüşdür. Harvard Tibb Məktəbinin biofiziki Taekjip Ha deyir ki, reaktivləşmə prosesinin tam olaraq necə işlədiyi hələ aydın deyil – lakin bu texnika canlı hüceyrələrdəki xüsusi kompleksləri seçici şəkildə araşdırmaq üçün dəyərli bir yol təqdim edir.
Ha hüceyrələrdə molekulyar yaxınlığın öyrənilməsi üçün başqa bir yanaşma üzrə ixtisaslaşmışdır: flüoresan rezonans enerjisinin ötürülməsi (FRET), burada bir flüorofor öz həyəcan enerjisini yaxınlıqdakı birinə köçürür. Enerji ötürülməsi PAPA-nın da niyə işlədiyini izah edə bilər, lakin texnikalar müxtəlif məsafələrdə işləyir: FRET siqnalı PAPA-nın təxminən yarısı məsafədə sönür. Bundan əlavə, FRET-də zülallar o qədər seyrək etiketlənir ki, ikisini bir-biri ilə kompleksdə tutmaq şansı çox aşağıdır.
Və Graham qeyd edir ki, FRET-dən fərqli olaraq, PAPA-da iki boya müxtəlif vaxtlarda həyəcanlanır, buna görə də fon flüoresansından heç bir müdaxilə yoxdur. Bu, yüksək protein konsentrasiyalarında tək molekullu görüntüləmə üçün vacibdir.
Molekulyar dinamika
Əvvəlcədən çapda Graham və onun həmkarları kinaz P-TEFb-nin transkripsiyanı necə aktivləşdirdiyini araşdırdılar. Normalda, RNT polimeraza bir genin transkripsiyasına başlayanda, ilk bir neçə onlarla əsasın transkripsiyasından sonra prosesi dayandırır; P-TEFb transkripsiyanı yenidən başlatır, lakin o, ribonukleoprotein kompleksi 7SK ilə bağlandıqda, bu fəaliyyət inhibə olunur. Tədqiqatçılar P-TEFb alt bölməsini, həmçinin 7SK kompleksinin alt bölməsi olan HEXIM1-i etiketlədilər. Komanda dörd cüt zülala PAPA tətbiq etdi və P-TEFb-7SK kompleksinin daha ağır molekulyar çəkisinə uyğun olaraq daha yavaş yayıldığını, lakin çox vaxt xromatinə bağlı olmadığını müəyyən etdi – bu, ümumiyyətlə kompleksin DNT-yə bağlı olmadığını göstərir. Sistemə bir P-TEFb inhibitorunun əlavə edilməsi P-TEFb və HEXIM1-in tez bir zamanda ayrılmasına səbəb oldu. “Hüceyrələri bu inhibitorla müalicə edərkən bütün kompleksin sinxron şəkildə dağıldığını görürük” dedi Graham.
Myong, hüceyrədaxili molekulların kortəbii olaraq fərqli hüceyrə bölmələrinə ayrıldığı bir fenomen olan faza ayrılması ilə bağlı öz araşdırmasında PAPA və tək molekullu izləməni birləşdirmək üçün bir neçə strategiya təklif edir. Myong qeyd edir ki, texnika onun öyrəndiyi komplekslərdə yeni oyunçuları aşkar edə bilməz, çünki tədqiqatçılar onları etiketləmək üçün komponentlərin şəxsiyyətlərini bilməlidirlər. “Ancaq etiketlənmiş düzgün zülallarınız varsa, bu şeyləri bir-bir xəritələməyə cəhd edə bilərsiniz, bu çox gözəl olardı.”
Bu vaxt, Graham və onun həmkarları transkripsiyanın molekulyar təfərrüatlarını doldurmaq üçün PAPA üzərində qurmağa davam edirlər. Hal-hazırda, Graham molekulların qarşılıqlı olub-olmadığını, həm də nə qədər müddətə təsir etdiyini müəyyən etmək üçün bu texnikadan istifadə edir; o, həm də şəkili palçıqlaşdıra bilən fon səs-küyü kimi görünən qeyri-spesifik reaktivləşmənin hesablanması yollarını inkişaf etdirməklə texnikanın spesifikliyini təkmilləşdirməyi hədəfləyir.
Yeni aparat da kömək edə bilər. Qrem, biofiziklər Erik Betziq və Sriqokul Upadhyayula və onların UC Berkeley-də postdoktu Amir Hay ilə tək molekulların daha çox sayda trayektoriyasını tuta bilən yeni mikroskop növü yaratmaq üçün əməkdaşlıq edir. Graham deyir: “Canlı hüceyrələrdə araşdırmaq üçün zülal qarşılıqlılığının bütün kainatı var”. İndi PAPA-fSMT sayəsində tədqiqatçılar nəhayət onları sınaq borularında deyil, yaşadıqları yerdə öyrənə biləcəklər.
doi: https://doi.org/10.1038/d41586-024-02964-8
Yeniləmələr və Düzəlişlər
- Düzəliş 18 Sentyabr 2024 : Bu texnologiya xüsusiyyətinin əvvəlki versiyasında Xavier Darzacq Robert Tjian ilə laboratoriya rəhbəri kimi müəyyən edilməli idi.
İstinadlar
- Graham, TGW, Ferrie, JJ, Dailey, GM, Tjian, R. & Darzacq, X. eLife 11 , e76870 (2022).Məqalə PubMed Google Alim
- Graham, TGW et al. bioRxiv https://doi.org/10.1101/2024.06.25.600644 (2024) ünvanında əvvəlcədən çap edin.