Riyaziyyata əsaslanan maşın öyrənməsi ilə hüceyrə inkişafının xəritələşdirilməsi
İnqrid Fadelli , Phys.org tərəfindən
redaktə edən: Gaby Clark , rəy verən: Robert Egan
Tercih edilən mənbə kimi əlavə edin
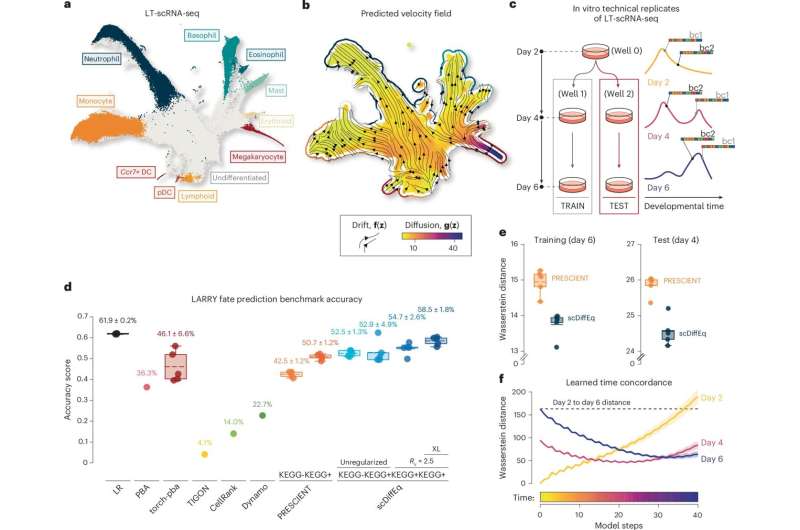
Nəsil izlənilən hematopoetik inkişaf məlumatlarından istifadə edərək scDiffEq performansının müqayisəsi. Kredit: Nature Machine Intelligence (2025). DOI: 10.1038/s42256-025-01150-3
İnsanların və digər heyvanların inkişafı zamanla tədricən inkişaf edir və hüceyrələr hüceyrə taleyinin təyini adlanan bir proses vasitəsilə müəyyən rol və funksiyaları yerinə yetirirlər. Fərdi hüceyrələrin taleyi, yəni onların hansı növ hüceyrəyə çevriləcəyi həm proqnozlaşdırıla bilən bioloji siqnallardan, həm də təsadüfi fizioloji dalğalanmalardan təsirlənir.
Son onilliklər ərzində tibb tədqiqatçıları və nevroloqlar təkhüceyrəli RNT ardıcıllığı (scRNA-seq) kimi tanınan bir texnikadan istifadə edərək bu prosesləri daha dərindən öyrənə bilmişlər. Bu, fərdi hüceyrələrin gen aktivliyini ölçmək üçün istifadə edilə bilən eksperimental bir vasitədir.
Hüceyrələrin zamanla necə inkişaf etdiyini daha yaxşı başa düşmək üçün tədqiqatçılar həmçinin riyazi modellərə də əsaslanırlar. Drift-diffuziya tənliyi adlandırılan bu modellərdən biri sistemlərin təkamülünü proqnozlaşdırıla bilən dəyişikliklərin (yəni, drift) və təsadüfiliyin (yəni, diffuziyanın) kombinasiyası kimi təsvir edir.
MIT-in Broad İnstitutu və Harvard, Massaçusets Ümumi Xəstəxanası və Harvard Tibb Məktəbinin tədqiqatçıları hüceyrə inkişafını və onların taleyinin müəyyən edilməsini öyrənmək üçün istifadə edilə bilən bu riyazi modelə əsaslanan yeni bir maşın öyrənmə çərçivəsi hazırladılar. scDiffEq adlanan bu çərçivə bu yaxınlarda Nature Machine Intelligence jurnalında dərc olunmuş bir məqalədə təqdim edildi .
Məqalənin həmmüəllifi Luka Pinello Phys.org-a bildirib ki, “Bu layihə mənim laboratoriyamla Getz laboratoriyası arasında ortaq bir doktorluq tələbəsi olan Maykl Vinyard sayəsində ortaya çıxdı. O, yeni hesablama modelləşdirmə yanaşmalarını araşdırmaq ehtirasından irəli gələrək eksperimental olaraq yönəlmiş laboratoriyadan hesablama biologiyasına yönəlmiş laboratoriyalarımıza keçdi.”scDiffEq alqoritminə ümumi baxış və tətbiqlər. Müəllif: Vinyard və digərləri, Nature Machine Intelligence (2025). DOI: 10.1038/s42256-025-01150-3.
Hüceyrə inkişafını öyrənmək üçün yeni qabaqcıl vasitələr
Pinello, Vinyard, Getz və həmkarları maşın öyrənməsi sahəsindəki son nailiyyətləri hüceyrə inkişafının öyrənilməsinə tətbiq etmək istəyirdilər. Onlar xüsusilə neyron stoxastik diferensial tənliklər adlanan riyazi modellərdən istifadə edərək hüceyrələrin “taleyini” necə seçdiyinə işıq salmağa çalışdılar.
Məqalənin həmmüəllifi Qad Getz bildirib ki, “Tək hüceyrə trayektoriyalarının dərin hesablama modelləşdirilməsi, dərman hədəflərini tapmaq və klinik müdaxilələrin dizaynı üçün vacib olan pozuntuların təsirini proqnozlaşdırmaq üçün istifadə edilə bilər”.
“Metodumuzu müqayisə etmək üçün istifadə etdiyimiz əsas nəsil izləmə məlumat dəstini (LARRY) hazırlayan Allon Kleinin dəstəyini qazandıqda komanda daha da gücləndi. Sahədəki həmkarlarımızla müzakirələrdən sonra Anders Rasmussen və Ruitong Li-nin mühüm töhfələri ilə bu modelləşdirmə çərçivəsi üzərində bir araya gəldik.”
Son bir neçə ildə toplanmış yüksək keyfiyyətli nəsil şəcərəsi ilə izlənilən məlumatları təhlil edərək, bu böyük tədqiqatçı qrupu yanaşmalarını təkmilləşdirdi. Onların birgə səyləri nəticədə scDiffEq çərçivəsinin hazırlanmasına gətirib çıxardı.
Məqalənin ilk müəllifi Maykl Vinyard izah etdi: “İnsan bədənindəki hüceyrə növlərinin müxtəlifliyinin proqramlı şəkildə tək bir pluripotent hüceyrədən yaranması fikri məni ilhamlandırdı”.
“Bu inkişaf prosesləri xəstəliklərdə ələ keçirilir; bir çox xərçəng hüceyrə taleyi ilə bağlı qərar qəbuletməni pozan mutasiyalara malikdir. Bir əsrdən çoxdur ki, diferensial tənliklər dinamik sistemlərin modelləşdirilməsi üçün əsas vasitə olmuşdur. Daha yaxınlarda, onlar hüceyrələrin bu qərarları necə verməsini idarə edən bioloji dövrələr olan gen tənzimləyici şəbəkələrinə tətbiq edilmişdir.”
Son illərdə tədqiqatçılar scRNA-seq və digər qabaqcıl eksperimental alətlərdən istifadə edərək getdikcə daha dəqiq və yüksək qətnaməli ölçmələr topladılar. Bu qabaqcıl üsullar onlara hər hüceyrədə 20.000-dən çox genin profilini yaratmağa imkan verdi , lakin bu hüceyrələrin inkişafını ənənəvi diferensial tənliklərə əsaslanan modellərdən istifadə edərək müəyyən etmək mümkün olmadı.
Vinyard bildirib ki, ” Neyron diferensial tənlikləri bunu dəyişdirərək, hüceyrə vəziyyətinin dinamikasını birbaşa məlumatlardan təsvir edən tənlikləri öyrənmək üçün bir çərçivə təmin etdi”.
“GPU ilə sürətləndirilmiş ədədi yaxınlaşma bizə sadə, məhdud sistemlərdən kənara çıxaraq hüceyrələrin yüksək ölçülü müşahidələrinə qədər miqyaslanmağa imkan verir. Əlinizdə öyrənilmiş tənliklərlə müşahidə olunan məlumatları uyğunlaşdırmaqdan daha çox şey edə bilərsiniz: pozğunluq altında hüceyrə davranışını simulyasiya edə, genetik və ya farmakoloji müdaxilələrin hüceyrə taleyinə necə təsir edə biləcəyi barədə fərziyyələr yarada bilərsiniz.”
Gündəlik məlumat üçün Phys.org-a etibar edən 100.000-dən çox abunəçi ilə elm, texnologiya və kosmosdakı ən son yenilikləri kəşf edin . Pulsuz bülletenimizə abunə olun və vacib olan nailiyyətlər, innovasiyalar və tədqiqatlar haqqında gündəlik və ya həftəlik yeniliklərdən xəbərdar olun .
scDiffEq modelinin əsasları və üstünlükləri
Tədqiqatçılar tərəfindən hazırlanmış yeni maşın öyrənməsinə əsaslanan çərçivə, neyron stoxastik diferensial tənliklərdən istifadə edərək hüceyrələrin zamanla necə dəyişdiyini modelləşdirir. Komanda bu modeldən hüceyrələrin taleyini (yəni, hansı növ hüceyrələrə çevriləcəklərini) proqnozlaşdırmaq üçün istifadə etməyə çalışdı.
Pinello izah etdi ki, “Hüceyrələri mənzərədən keçən hissəciklər kimi düşünün: bəzi qüvvələr onları müəyyən istiqamətlərə itələyir (deterministik tənzimləyici proqramları təmsil edən ‘sürüşmə’), təsadüfi dalğalanmalar isə onların yoluna təsir göstərir (bioloji səs-küyü təmsil edən ‘diffuziya’). Əvvəlki metodlar bioloji səs-küyü bütün hüceyrələr və hüceyrə vəziyyətləri arasında vahid hesab edirdi. Bunun əvəzinə scDiffEq fərqli hüceyrə vəziyyətlərinin fərqli stoxastik səviyyələrdə yaşadığını öyrənir ki, bu da real bioloji sistemləri daha yaxşı əks etdirə bilər.”
Tədqiqatçılar öz çərçivələrinin potensialını qiymətləndirmək üçün əvvəlcə real scRNA-seq məlumatlarından istifadə edərək qan hüceyrələrinin inkişafını izləmək üçün bundan istifadə etdilər. Onların modelinin fərdi hüceyrələrin taleyini 58% dəqiqliklə proqnozlaşdırdığı aşkar edildi ki, bu da əvvəllər təqdim edilmiş modellərin əldə etdiyindən 8% çoxdur.
Vinyard bildirib ki, “scDiffE, hüceyrələrin zamanla vəziyyətini necə dəyişdiyini təsvir edən tənlikləri tək hüceyrəli məlumatlardan öyrənir. Əsasən, o, neyron stoxastik diferensial tənliklər üzərində qurulub və hüceyrə vəziyyəti dəyişikliyini idarə edən həm deterministik (drift), həm də stoxastik (diffuziya) dinamikasını parametrləşdirmək üçün neyron şəbəkələrindən istifadə edir.”
Komandanın modelinin yeni bir xüsusiyyəti, hüceyrənin vəziyyətinin funksiyası olaraq hüceyrə inkişafına təsir edən proqnozlaşdırıla bilən (yəni, sürüşmə) və təsadüfi (yəni, diffuziya) amilləri öyrənməsidir. Bu, əvvəllər təqdim edilən maşın öyrənməsinə əsaslanan modellərlə kəskin şəkildə ziddiyyət təşkil edir, hansılar ki, diffuziyanı ya tamamilə nəzərə almır, ya da onu bütün hüceyrələr üzrə sabit kimi qəbul edirlər.
Vinyard bildirib ki, “scDiffEq, stoxastikliyin özünün hüceyrə mənzərəsində necə dəyişdiyini öyrənir: taleyin qərarında olan bir əcdad hüceyrə, terminal olaraq fərqlənmiş hüceyrədən fərqli stoxastiklik profilinə malik ola bilər”.
“Təcrübədə, siz hüceyrələrə zaman məlumatları (real və ya təxmini) verirsiniz və o, hüceyrə halı fəzası üzərində vektor sahəsini öyrənir. Təlim keçdikdən sonra istənilən başlanğıc populyasiyadan trayektoriyaları simulyasiya edə, hüceyrə taleyinin nəticələrini proqnozlaşdıra və ya pozuntular tətbiq edib nəticədə yaranan dəyişiklikləri öyrənə bilərsiniz.”
Neyrologiya və tibbi tədqiqatlar üçün yeni yollar
Bu yaxınlarda aparılan tədqiqat göstərir ki, hüceyrə vəziyyətindən asılı olan “təsadüfilik”in açıq modelləşdirilməsi hüceyrə taleyinin proqnozlaşdırılmasını əhəmiyyətli dərəcədə yaxşılaşdıra bilər. Gələcəkdə digər komandalar da onların işlərindən ilham ala və neyron stoxastik diferensial tənliklər əsasında idarə olunan oxşar maşın öyrənmə modelləri hazırlamağa başlaya bilərlər.
“Nəticələrimiz göstərir ki, hüceyrələr inkişaf zamanı qəsdən ‘səs-küyü’ dəyişdirən proqramlaşdırılmış modullara malik ola bilər və bunu dəqiq modelləşdirmə üçün qeyd etmək vacibdir”, – deyə Pinello bildirib.
“Həmçinin, modelimizin gen səviyyəsində pozuntuların təsirini proqnozlaşdıra biləcəyini araşdırdıq, çünki bu, potensial terapevtik müdaxilələrin in silico qiymətləndirilməsi üçün vacib bir vasitə ola bilər. scDiffEq yüksək qətnaməli inkişaf trayektoriyalarını yenidən qura və silico genom geniş pozuntu ekranlarında çıxış edə bilər. O, həmçinin mövcud tək hüceyrəli təcrübələrin əksəriyyətini təmsil edən tək zaman nöqtəsi məlumat dəstlərinə ümumiləşdirir.”
Növbəti tədqiqatlarının bir hissəsi olaraq, Vinyard, Pinello, Getz və həmkarları scDiffEq modelini daha da təkmilləşdirməyi və onun bəzi məhdudiyyətlərini aradan qaldırmağı planlaşdırırlar. Məsələn, hazırda model daha aşağı ölçülü məkanda fəaliyyət göstərir, çünki bütün genləri açıq şəkildə modelləşdirmək çox çətin olacaq. Gələcəkdə onlar genləri birbaşa və etibarlı şəkildə xəritələşdirə bilən daha miqyaslı modellər təqdim etməyə ümid edirlər.
Pinello əlavə edib ki, “Biz hazırda yalnız gen ifadə səviyyələrindən istifadə edirik. Nəhayət, daha əhatəli modellər qurmaq üçün xromatin əlçatanlığı kimi digər molekulyar təbəqələri inteqrasiya etməyi planlaşdırırıq.”
“Nəhayət, tək hüceyrəli ölçmələri tez-tez Perturb-seq adlandırılan CRISPR pozuntuları ilə birləşdirən son genişmiqyaslı təcrübələrdən əldə edilən pozuntu məlumatlarını inteqrasiya etmək üçün böyük bir fürsət var . Bu cür məlumatlar üzərində təlim in-silico pozuntu proqnozlarımızı əhəmiyyətli dərəcədə yaxşılaşdıra bilər.”
Müəllifimiz İnqrid Fadelli tərəfindən sizin üçün yazılmış, Qeb Klark tərəfindən redaktə edilmiş və Robert İqan tərəfindən faktlar yoxlanılmış və nəzərdən keçirilmiş bu məqalə diqqətli insan əməyinin nəticəsidir. Müstəqil elmi jurnalistikanı yaşatmaq üçün sizin kimi oxuculara güvənirik. Əgər bu reportaj sizin üçün vacibdirsə, xahiş edirik ianə etməyi (xüsusilə aylıq) nəzərdən keçirin. Təşəkkür olaraq reklamsız hesab əldə edəcəksiniz .
Nəşr detalları
Michael E. Vinyard və digərləri, Neyron diferensial tənlikləri ilə hüceyrə dinamikasının öyrənilməsi, Nature Machine Intelligence (2025). DOI: 10.1038/s42256-025-01150-3 .
Jurnal məlumatı: Təbiət Maşın Zəkası
Əsas anlayışlar
inkişaf biologiyasıDNT ardıcıllığıHüceyrə quruluşu, fiziologiyası və dinamikasıDalğalanmalar və səs-küyMayelərdə qeyri-xətti dinamikaStoxastik proseslərBioloji şəbəkələr
© 2026 Science X Network