Tədqiqatçılar Alzheimer xəstəliyinin təsirini geri qaytarmaq üçün mümkün həll yollarını kəşf edirlər

Yeni tapıntılar Alzheimer xəstəliyində amiloid lövhələrini açmaq və deqradasiya etmək üçün müalicədə faydalı ola bilər.
Chapel Hilldəki Şimali Karolina Universitetinin tədqiqatçıları bədən istiliyinə cavab olaraq dərmanları açmaq və buraxmaq üçün nəzərdə tutulmuş spiral amiloid liflərindən istifadə edən yeni dərman daşıma platforması hazırlayıblar.
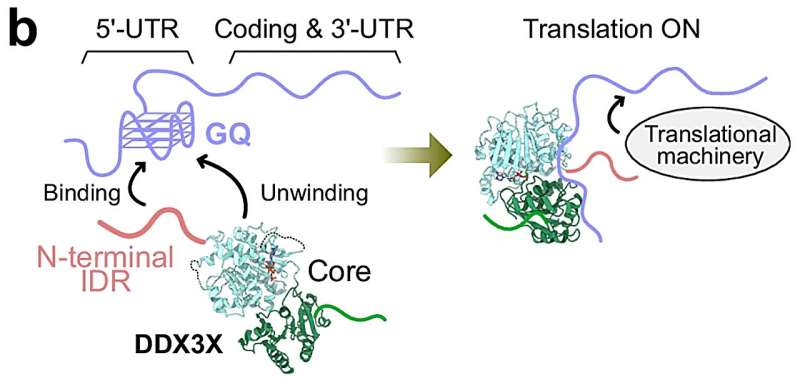
Nature Communications -da nəşr olunan yeni bir araşdırma yazısı, Alzheimer xəstəliyi kimi xəstəliklərin necə meydana gəldiyinə dair təməlqoyma struktur detallarını ortaya qoyur . Bu biliklə qrup həm əmanətləri, həm də onların bu şərtlərdən əziyyət çəkənlərə təsirini geri qaytarmaq üçün unikal mexanizm aşkar etmiş ola bilər.
UNC-Chapel Hill tədqiqatçısı Ronit Freeman, Emory Universitetindəki Lynn laboratoriyasının müstəntiqləri ilə bir araşdırma qrupuna rəhbərlik edir, əsas beta amiloid-42 peptidinə, amiloid lövhəsinin yığılmasını idarə edən əsas hissəyə və Alzheimer xəstəliyi olan xəstələrin beyinlərində çöküntülərə baxdı. Laboratoriyada peptidin sintetik variasiyalarını yaradaraq, onlar bu molekulların yığılma və bükülmə üsulunu necə idarə etməyi kəşf edə bildilər.
Sintetik peptid innovasiyası
“Bu amiloid materiallarının bükülmə və deqradasiyaya uğrama qabiliyyəti, Alzheimer və digər neyrodegenerativ xəstəliklərdə aşkar edilmiş lövhələri dəyişdirən və sonradan geri qaytaran müalicələr üçün potensialı vurğulayır” dedi Freeman. “Biz bilirik ki, amiloid fibrilinin bükülmə istiqaməti xəstəliyin müxtəlif inkişaf halları ilə əlaqələndirilir. Təsəvvür edin ki, sadə bir müalicə ilə biz amiloidləri dəyişdirərək onların formasını dəyişdirə və yoxa çıxa bilərik – bu, bizim kəşfimizə gələcəkdə bunu etməyə imkan verə bilər”.
Qabaqcıl spektroskopik üsullardan istifadə edərək, tədqiqatçılar fərdi peptidlərin necə qarşılıqlı əlaqədə olduğunu tədqiq etdilər, yığılma sürətləri, peptidlər arasındakı məsafələr, peptidlərin düzülməsi və ən əsası bükülmə istiqaməti haqqında məlumatları ortaya qoydular. Müxtəlif temperaturlarda materialların morfologiyasını xarakterizə etmək üçün yüksək ayırdetmə qabiliyyətinə malik elektron və flüoresan mikroskopiyadan istifadə edilmişdir.
Tədqiqatçılar müəyyən etdilər ki, peptidin N-terminal sahəsi borular, lentlər və ya liflər kimi montajın formasını proqramlaşdırmaq üçün vacibdir, C-terminal modifikasiyaları isə materialın ya sol, ya da sağ əli ilə bükülməsini istiqamətləndirir. Bu dizayn qaydalarından istifadə edərək, dəyişən temperaturlara cavab olaraq sol və sağ əlli bükülmüş lentlər arasında tələbata uyğun keçid etmək üçün bir sıra peptidlər tənzimləndi. Bu dönmə inversiya daha sonra materialı təbii zülallar tərəfindən deqradasiyaya həssas edir, bu, çatdırılma vasitəsi kimi istifadə olunan materiallar üçün arzuolunan xüsusiyyətdir.