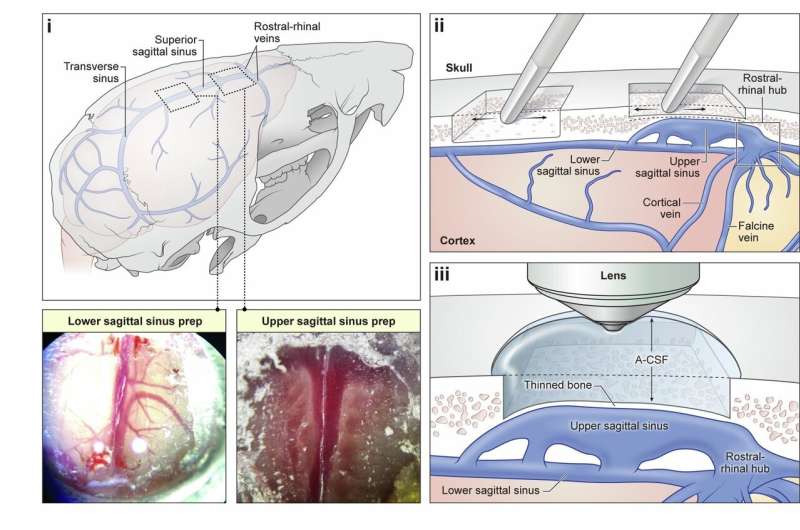
Zülal qatlanan sirr həll edildi: Tədqiqat əsas qablaşdırma fraksiyalarını izah edir
Canlı orqanizmlərdə yüzlərlə amin turşusundan ibarət bioloji polimer növü olan hər zülal kataliz, molekulların daşınması və ya DNT təmiri kimi xüsusi funksiyaları yerinə yetirir. Bu funksiyaları yerinə yetirmək üçün onlar xüsusi formalara qatlanmalıdırlar. Bu, həyat üçün kritik əhəmiyyət kəsb edən mürəkkəb bir prosesdir və bu sahədə irəliləyişlərə baxmayaraq, proseslə bağlı çoxlu açıq suallar qalmaqdadır.
PRX Life -da nəşr olunan bir araşdırma bu məsələyə bir qədər işıq salır və dərman terapevtikləri, yeni biomateriallar və digər tətbiqlər üçün zülalların dizaynının yeni yollarına səbəb ola bilər.
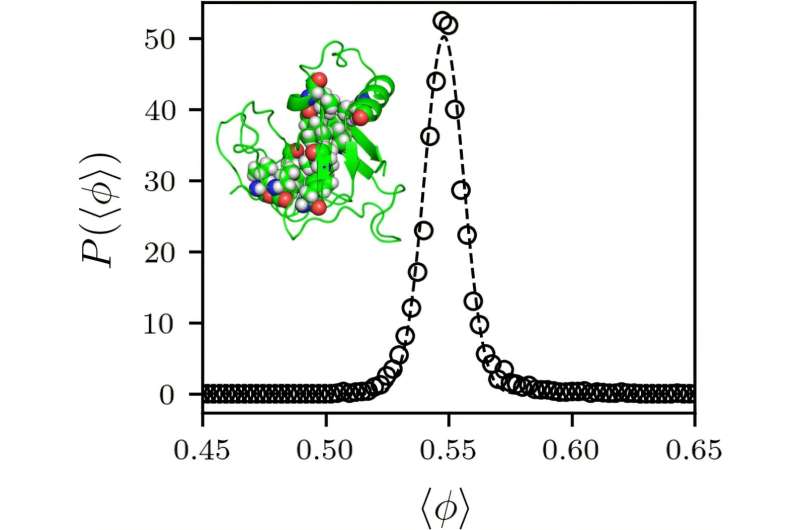
Kori O’Hernin rəhbərlik etdiyi tədqiqatçılar onlayn verilənlər bazası olan Protein Məlumat Bankında bütün qlobulyar zülallar üçün hesablama modelləri işləyib hazırladılar və onların nə qədər sıx yığıldığını müəyyən etmək üçün onların daxili nüvə bölgələrini ölçdülər. Hər zülalın 55% əsas qablaşdırma hissəsi var. Yəni məkanın 55%-ni atomlar tuturdu. Bu, tədqiqat qrupunu iki suala vadar etdi.
“Niyə onların hamısı eyni dəyərə sahib idi? Və konkret olaraq, niyə bu dəyər 55% təşkil edir?” maşınqayırma, materialşünaslıq, fizika və tətbiqi fizika professoru O’Hern dedi. “Cavab belə görünür ki, zülal nüvələri sıxıldıqda və ya sərtləşdikdə qablaşdırma fraksiyasının artması dayanır.”
Yəni, zülalın nüvəsini təşkil edən fərdi amin turşuları zülal qatlananda daha sıxışa bilmədi. Obyektlərin bir-birinə sıxışdığı qablaşdırma hissəsi əsasən onların formasından asılıdır. Sferik obyektlər, məsələn, 64% qablaşdırma fraksiyasında sıxışır.
“Ancaq amin turşularının mürəkkəb formaları var ” dedi O’Hern.
“Bir neçə amin turşusu kifayət qədər sferikdir, lakin onların əksəriyyəti yan zəncirlərə görə uzanır və bütün birləşmiş hidrogen atomlarına görə kobud olur. Yumşaq maddənin fizikası bizə deyir ki, uzunsov, kələ-kötür hissəciklərin sıxışdırılmış paketləri tıxaclı qablaşdırmalar qədər sıx şəkildə yığılmır.
https://googleads.g.doubleclick.net/pagead/ads?client=ca-pub-0536483524803400&output=html&h=135&slotname=8188791252&adk=2329133447&adf=4054963813&pi=t.ma~as.8188791252&w=540&abgtt=6&fwrn=4&lmt=1743418909&rafmt=11&format=540×135&url=https%3A%2F%2Fphys.org%2Fnews%2F2025-03-protein-mystery-core-fractions.html&wgl=1&uach=WyJXaW5kb3dzIiwiMTkuMC4wIiwieDg2IiwiIiwiMTM0LjAuNjk5OC4xNzgiLG51bGwsMCxudWxsLCI2NCIsW1siQ2hyb21pdW0iLCIxMzQuMC42OTk4LjE3OCJdLFsiTm90OkEtQnJhbmQiLCIyNC4wLjAuMCJdLFsiR29vZ2xlIENocm9tZSIsIjEzNC4wLjY5OTguMTc4Il1dLDBd&dt=1743418909515&bpp=1&bdt=45&idt=90&shv=r20250327&mjsv=m202503260101&ptt=9&saldr=aa&abxe=1&cookie=ID%3De2af2bea6b3e2e90%3AT%3D1735548424%3ART%3D1743418606%3AS%3DALNI_MZIaWdAh-lthHlhpkWN2g6ZC7xT8A&gpic=UID%3D00000f8412a58936%3AT%3D1735548424%3ART%3D1743418606%3AS%3DALNI_MaJ_6ILTTPz6uEc3lU2rNf9ZPgQbA&eo_id_str=ID%3D1b1b09cf233e1b4b%3AT%3D1735548424%3ART%3D1743418606%3AS%3DAA-AfjZKostxhmsFX2YCqOZbTGHa&prev_fmts=0x0&nras=1&correlator=7866217442503&frm=20&pv=1&rplot=4&u_tz=240&u_his=3&u_h=864&u_w=1536&u_ah=816&u_aw=1536&u_cd=24&u_sd=1.25&dmc=8&adx=395&ady=2137&biw=1521&bih=730&scr_x=0&scr_y=0&eid=31090665%2C31091180%2C95356499%2C95356504%2C31091361%2C31088250%2C95355300%2C95356787%2C95356928%2C95340252%2C95340254&oid=2&pvsid=4033511565508217&tmod=998620750&uas=0&nvt=1&ref=https%3A%2F%2Fphys.org%2Fpage2.html&fc=1920&brdim=0%2C0%2C0%2C0%2C1536%2C0%2C1536%2C816%2C1536%2C730&vis=1&rsz=%7C%7CpeEbr%7C&abl=CS&pfx=0&fu=128&bc=31&bz=1&td=1&tdf=2&psd=W251bGwsbnVsbCxudWxsLDNd&nt=1&ifi=2&uci=a!2&btvi=1&fsb=1&dtd=96
Maraqlı gələcək istiqamət, zülal nüvəsinin qablaşdırma fraksiyasının fizioloji şəraitdə zülallar üçün tapılandan daha sıx ola biləcəyidir. Məsələn, dərin okean hidrotermal ventilyasiyalarında təzyiqləri təqlid edən yüksək təzyiqlərdə zülallar üzərində tədqiqatlar aparılmışdır ki, bu da ehtimal ki, üzvi molekulların orijinal sintezi ilə bağlıdır.
Yüksək təzyiqlərdə zülalların struktur xarakteristikası göstərdi ki, zülal nüvəsinin qablaşdırma fraksiyası 58-60%-ə qədər arta bilər. Beləliklə, bu araşdırma həm də həyatın mənşəyi haqqında anlayışımızla bağlıdır.
“İndi biz zülal nüvələrinin xassələrini tipik qatlama şəraitində bildiyimiz üçün, ola bilsin ki, zülal nüvəsinin qablaşdırılmasının 55%-də dayanmasına ehtiyac yoxdur”, – Ph.D Aleks Qriqas bildirib. O’Hern laboratoriyasında namizəd və məqalənin aparıcı müəllifi.
“Əgər siz həlledici şərtləri, təzyiqi və ya temperatur sıçrayışını dəyişdirsəniz, amin turşularının daha səmərəli şəkildə yığılmasına nail ola bilərsiniz.”
O’Hern əlavə etdi ki, zülal dizaynı hazırda yeni zülal strukturları və funksiyalarını hazırlamaq üçün amin turşularının yeni ardıcıllığının yaradılmasına yönəlib.
“İndi, bu iş hətta eyni amin turşusu ardıcıllığı ilə , sadəcə qatlama şərtlərini dəyişdirərək yeni protein strukturlarını və funksiyalarını dizayn edə biləcəyiniz ehtimalını açır .”
Daha çox məlumat: Alex T. Grigas et al, Protein Folding as a Jamming Transition, PRX Life (2025). DOI: 10.1103/PRXLife.3.013018
Jurnal məlumatı: PRX Life
Yale Universiteti tərəfindən təmin edilmişdir