Zülal terapiyası şəkər “əyləclərini” geri qaytarmaqla şişlərə qarşı immun hücumunu gücləndirir
Massaçusets Texnologiya İnstitutu tərəfindən
Sadie Harley tərəfindən redaktə edilib , Robert Egan tərəfindən nəzərdən keçirilib
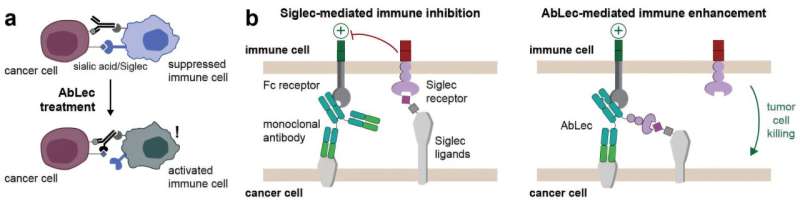
Redaktorların qeydləriAbLecs, qliko-immun yoxlama nöqtəsinin blokadası vasitəsilə antikor effektor funksiyalarını artırır. Mənbə: bioRxiv . DOI: 10.1101/2022.10.26.513931
MIT və Stanford Universitetinin tədqiqatçıları xərçəng immunoterapiyasının daha çox xəstə üçün təsirli olmasını təmin edə biləcək bir strategiyadan istifadə edərək, immunitet sistemini şiş hüceyrələrinə hücum etmək üçün stimullaşdırmaq üçün yeni bir yol hazırlayıblar.
Onların yanaşmasının əsas məqsədi xərçəng hüceyrələrinin immun hüceyrələrinin hücuma başlamasının qarşısını almaq üçün istifadə etdiyi “əyləci” geri çevirməkdir. Bu əyləc xərçəng hüceyrələrinin səthində olan qlikanlar kimi tanınan şəkər molekulları tərəfindən idarə olunur.
Tədqiqatçılar bu qlikanları lektin adlanan molekullarla bloklamaqla immun sisteminin xərçəng hüceyrələrinə qarşı reaksiyasını əhəmiyyətli dərəcədə artıra biləcəklərini göstərdilər. Buna nail olmaq üçün onlar lektini şişi hədəf alan antikorla birləşdirən AbLecs kimi tanınan çoxfunksiyalı molekullar yaratdılar.
Bioloji Mühəndislik və Kimya Mühəndisliyi kafedralarında çalışan Underwood-Prescott Karyera İnkişafı Professoru Cessika Stark deyir: “Biz qlikan əsaslı immun nəzarət nöqtələrini bloklaya və xərçəng əleyhinə immun reaksiyalarını artıra bilən yeni bir protein terapevtik növü yaratdıq”.
“Qlikanların bir çox şiş növündə xərçəngə qarşı immun reaksiyasını məhdudlaşdırdığı məlum olduğundan, molekullarımızın bir çox xərçəng xəstəsi üçün yeni və potensial olaraq daha təsirli müalicə variantları təklif edə biləcəyindən şübhələnirik.”
MIT-in Koch İnteqrativ Xərçəng Tədqiqatları İnstitutunun üzvü olan Stark, məqalənin aparıcı müəllifidir. Stanford Universitetinin kimya professoru və Sarafan ChEM İnstitutunun direktoru Kerolin Bertozzi isə ” Nature Biotechnology” jurnalında dərc olunan tədqiqatın baş müəllifidir .
Əyləclərin buraxılması
İmmunitet sistemini şiş hüceyrələrini tanımaq və məhv etmək üçün öyrətmək bir çox xərçəng növünün müalicəsində perspektivli bir yanaşmadır. Yoxlama nöqtəsi inhibitorları kimi tanınan immunoterapiya dərmanlarının bir sinfi, PD-1 və PD-L1 zülalları arasındakı qarşılıqlı təsiri bloklayaraq immun hüceyrələrini stimullaşdırır. Bu, şiş hüceyrələrinin T hüceyrələri kimi immun hüceyrələrinin xərçəng hüceyrələrini öldürməsinin qarşısını almaq üçün istifadə etdiyi bir əyləci aradan qaldırır.
PD-1-PD-L1 nəzarət nöqtəsini hədəf alan dərmanlar bir neçə növ xərçəngin müalicəsi üçün təsdiqlənib. Bu xəstələrin bəzilərində nəzarət nöqtəsi inhibitorları uzunmüddətli remissiyaya səbəb ola bilər, lakin bir çoxları üçün heç bir təsir göstərmir.
Daha çox sayda xəstədə immun reaksiyaları yaratmaq ümidi ilə tədqiqatçılar hazırda xərçəng hüceyrələri ilə immun hüceyrələri arasında digər immunosupressiv qarşılıqlı təsirləri hədəf almaq yolları üzərində işləyirlər. Belə qarşılıqlı təsirlərdən biri şiş hüceyrələrindəki qlikanlar və immun hüceyrələrində olan reseptorlar arasında baş verir.
Qlikanlar demək olar ki, bütün canlı hüceyrələrdə olur, lakin şiş hüceyrələri tez-tez sağlam hüceyrələrdə olmayan qlikanları, o cümlədən sial turşusu adlanan monosaxarid ehtiva edən qlikanları ifadə edir. Sial turşuları immun hüceyrələrində yerləşən lektin reseptorlarına bağlandıqda, immun hüceyrələrində immunosupressiv yolu işə salır. Sial turşusuna bağlanan bu lektinlər Siglec kimi tanınır.
Stark deyir ki, “İmmun hüceyrələrindəki Sigleclər xərçəng hüceyrələrindəki sial turşularına bağlandıqda, immun reaksiyasını tormozlayır. Bu, PD-1-in PD-L1-ə bağlandığı zaman baş verdiyi kimi, həmin immun hüceyrəsinin xərçəng hüceyrəsinə hücum etmək və məhv etmək üçün aktivləşməsinin qarşısını alır”.
Hazırda, bir sıra dərman inkişaf yanaşmaları sınaqdan keçirilsə də, bu Siglec-sial turşusu qarşılıqlı təsirini hədəf alan heç bir təsdiqlənmiş terapiya yoxdur. Məsələn, tədqiqatçılar sial turşularına bağlana və onların immun hüceyrələri ilə qarşılıqlı təsirinin qarşısını ala bilən lektinlər hazırlamağa çalışıblar, lakin indiyə qədər bu yanaşma yaxşı nəticə verməyib, çünki lektinlər xərçəng hüceyrələrinin səthində çoxlu sayda toplanacaq qədər güclü şəkildə bağlanmır.
Bunun öhdəsindən gəlmək üçün Stark və həmkarları xərçəng hüceyrələrini hədəf alan antikorlara birləşdirərək daha çox miqdarda lektin çatdırmaq üçün bir yol hazırladılar. Oraya çatdıqdan sonra lektinlər sial turşusuna bağlana bilər və sial turşusunun immun hüceyrələrindəki Siglec reseptorları ilə qarşılıqlı təsirinin qarşısını alır.
Bu, immun reaksiyasının qarşısını alır və makrofaqlar və təbii qatil (NK) hüceyrələri kimi immun hüceyrələrinin şişə hücum etməsinə imkan verir.
Stark deyir ki, “Bu lektin bağlayıcı domen adətən nisbətən aşağı yaxınlığa malikdir, ona görə də onu təkbaşına terapevtik vasitə kimi istifadə edə bilməzsiniz. Lakin lektin domeni yüksək yaxınlığa malik antikorla əlaqəli olduqda, onu xərçəng hüceyrəsinin səthinə çatdıra bilərsiniz və burada sial turşularına bağlana və onları bloklaya bilər”.
Modulyar sistem
Bu tədqiqatda tədqiqatçılar HER2-yə bağlanan və döş, mədə və kolorektal xərçənglərin müalicəsi üçün xərçəng müalicəsi kimi təsdiqlənmiş antikor trastuzumab əsasında AbLec hazırladılar . AbLec-i yaratmaq üçün onlar antikorun bir qolunu Siglec-7 və ya Siglec-9 lektinlə əvəz etdilər.
Laboratoriyada yetişdirilən hüceyrələrdən istifadə edərək aparılan testlər göstərib ki, bu AbLec xərçəng hüceyrələrinə hücum etmək və onları məhv etmək üçün immun hüceyrələrini yenidən işə salıb.
Tədqiqatçılar daha sonra AbLec-lərini insan Siglec reseptorlarını və antikor reseptorlarını ifadə etmək üçün hazırlanmış siçan modelində sınaqdan keçirdilər. Daha sonra bu siçanlara ağciyərlərdə metastaz əmələ gətirən xərçəng hüceyrələri yeridildi. AbLec ilə müalicə edildikdə, bu siçanlarda yalnız trastuzumab ilə müalicə olunan siçanlara nisbətən daha az ağciyər metastazları müşahidə edildi.
Tədqiqatçılar həmçinin göstəriblər ki, onlar CD20-ni hədəf alan rituksimab və ya EGFR-i hədəf alan setuksimab kimi digər şişə xas antikorlarla da mübadilə edə bilərlər. Onlar həmçinin immunosupressiyada iştirak edən digər qlikanları hədəf alan lektinlərlə və ya PD-1 kimi nəzarət nöqtəsi zülallarını hədəf alan antikorlarla da mübadilə edə bilərlər.
Stark deyir ki, “AbLec-lər həqiqətən qoşulub-işləyə biləndir. Onlar modulyardırlar”.
“Lektin reseptor ailəsinin müxtəlif üzvlərini hədəf almaq üçün müxtəlif reseptor domenlərini dəyişdirməyi təsəvvür edə bilərsiniz və həmçinin antikor qolunu da dəyişdirə bilərsiniz. Bu vacibdir, çünki fərqli xərçəng növləri fərqli antigenləri ifadə edir və antikor hədəfini dəyişdirməklə bunları həll edə bilərsiniz.”
Stark, Bertozzi və başqaları hazırda aparıcı AbLec namizədlərinin hazırlanması üzərində işləyən Valora Therapeutics adlı bir şirkət qurdular. Onlar yaxın iki-üç il ərzində klinik sınaqlara başlamağı ümid edirlər.
Daha çox məlumat
Qliko-immun yoxlama məntəqəsinin blokadası üçün antikor-lektin ximerləri, Nature Biotechnology (2025). DOI: 10.1038/s41587-025-02884-6 . BioRxiv haqqında . DOI: 10.1101/2022.10.26.513931
Jurnal məlumatı: Təbiət Biotexnologiyası , bioRxiv
Əsas tibbi anlayışlar
Trastuzumab İmmunitet Nəzarət Nöqtəsi İnhibitorlarıMassaçusets Texnologiya İnstitutu tərəfindən təmin edilir